Состав крови
Плазма крови – жидкая опалесцирующая жидкость желтоватого цвета, которая состоит на 91-92% из воды. Она содержит в своем составе органические и неорганические вещества.
Органические – белки(7-8% или 60-82 г/л), остаточный азот – в результате белкового обмена(мочевина, мочевая кислота, креатинин, креатин, амиак) – 15-20ммол/л. Этот показатель характеризует работу почек. Рост этого показателя свидетельствует о почечной недостаточности. Глюкоза – 3,33-6,1ммол/л — диагностируется сахарный диабет.
Неорганические – соли(катионы и анионы) – 0,9%
Белки плазмы и их функции
Альбумины. Их содержится в крови 4,5-6,7%, т.е. 60-65% всех плазменных белков приходится на долю альбуминов. Они выполняют в основном питательно-пластическую функцию. Не менее важна транспортная роль альбуминов, так как они могут связывать и транспортировать не только метаболиты, но лекарства. При большом накоплении жира в крови часть его тоже связывается альбуминами. Поскольку альбуминам принадлежит очень высокая осмотическая активность, на их долю приходится до 80% всего коллоидно-осмотического (онкотического) давления крови. Поэтому уменьшение количества альбуминов ведет к нарушению водного обмена между тканями и кровью и появлению отеков. Синтез альбуминов происходит в печени.
Глобулиныобычно всюду сопутствуют альбуминам и являются наиболее распространенными из всех известных белков. Общее количество глобулинов в плазме составляет 2,0-3,5%, т.е. 35-40% от всех белков плазмы. По фракциям их содержание следующее:
- альфа1-глобулины— 0,22-0,55 г% (4-5%)
- альфа2-глобулины- 0,41-0,71г% (7-8%)
- бета-глобулины — 0,51-0,90 г% (9-10%)
- гамма-глобулины— 0,81-1,75 г% (14-15%)
Фибриноген. Этот белок составляет 0,2-0,4 г%, около 4% от всех белков плазмы крови. Имеет непосредственное отношение к свертыванию, во время которого выпадает в осадок после полимеризации.
Протромбин-белок плазмы крови человека и животных, важнейший компонент системы свёртывания крови.
Другие вещества:
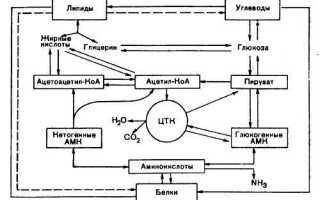
Липиды (жиры) – нерастворимы в воде, и поэтому они не могут транспортироваться кровью в чистом виде. Однако в крови липиды находятся в связанном с транспортными белками состоянии и приобретают растворимость. Образовавшееся химическое соединение носит название липопротеид или липопротеин. Выделяют несколько классов данных соединений:
·липопротеины очень низкой плотности (ЛПОНП) – образуются в печени, содержат липиды (холестерин и триглицериды) которые переносят с кровью к тканям;
·липопротеиды низкой плотности (ЛПНП) – образуются из ЛПОНП за счет выхода из них триглицеридов и содержат в основном холестерин;
·липопротеиды высокой плотности (ЛПВП)– транспортируют неиспользованный холестерин от тканей в печень, где из него синтезируются желчные кислоты.
Гормоны—биологически активные вещества органической природы, вырабатывающиеся в специализированных клетках желёз внутренней секреции, поступающие в кровь, связывающиеся с рецепторами клеток-мишеней и оказывающие регулирующее влияние на обмен веществ ифизиологические функции. Гормоны служат гуморальными (переносимыми с кровью) регуляторами определённых процессов в различных органах и системах.
Витамины— группа низкомолекулярных органических соединений относительно простого строения и разнообразной химической природы.
Ферменты,или энзимы— обычно белковые молекулы или молекулы РНК(рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции в живых системах.
Аминокислоты-органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Продукты обмена(мочевина,азот и др)
Минеральные вещества(кальцый, натрий, калий, железо , цинк , медь)
Осмотическое давление в норме приравнивается концентрации. Натрий хлорид 0,9%(физраствор)
pH-КЩР-кислотно-щелочное равновесие.
Кровь имеет 37,36 pH- слабощелочная.
При заболеваниях:
Ацидоз — смещение кислотно-щелочного баланса организма в сторону увеличения кислотности.
Алкалоз — нарушение кислотно-щелочного равновесия организма в сторону увеличения щелочности.
Гомеостаз — саморегуляция, способность открытой системы сохранять постоянство своего внутреннего состояния посредством скоординированных реакций, направленных на поддержание динамического равновесия.
Физико-химические свойства
Цвет крови. Определяется наличием в эритроцитах особого белка — гемоглобина.
Относительная плотность крови. Колеблется от 1,058 до 1,062 и зависит преимущественно от содержания эритроцитов. Относительная плотность плазмы крови в основном определяется концентрацией белков и составляет 1,029—1,032.
Вязкость крови. Определяется по отношению к вязкости воды и соответствует 4,5—5,0. Вязкость крови зависит главным образом от содержания эритроцитов и в меньшей степени от белков плазмы.
Осмотическим давлением называется сила, которая заставляет переходить растворитель (для крови это вода) через полупроницаемую мембрану из менее в более концентрированный раствор. Осмотическое давление крови зависит в основном от растворенных в ней низкомолекулярных соединений, главным образом солей. Около 60% этого давления создается NaCl. Поддержание постоянства осмотического давления играет чрезвычайно важную роль в жизнедеятельности клеток.
Онкотическое давление. Является частью осмотического и зависит от содержания крупномолекулярных соединений (белков) в растворе.
Онкотическое давление играет важную роль в регуляции водного обмена. Чем больше его величина, тем больше воды удерживается в сосудистом русле и тем меньше ее переходит в ткани и наоборот. Онкотическое давление влияет на образование тканевой жидкости, лимфы, мочи и всасывание воды в кишечнике. Поэтому кровезамещающие растворы должны содержать в своем составе коллоидные вещества, способные удерживать воду.
При снижении концентрации белка в плазме развиваются отеки, так как вода перестает удерживаться в сосудистом русле и переходит в ткани.
Температура крови. Во многом зависит от интенсивности обмена веществ того органа, от которого оттекает кровь, и колеблется в пределах 37—40°С. При движении крови не только происходит некоторое выравнивание температуры в различных сосудах, но и создаются условия для отдачи или сохранения тепла в организме.
Постоянство рН крови поддерживается буферными системами: гемоглобиновой, карбонатной, фосфатной и белками плазмы.
Клетки крови — форменные эллементы
1.Клетки красного ряда – эритроциты
2.Клетки белого ряда — лейкоциты
3.Тромбоциты
Эритроциты составляют основную массу форменных элементов крови. Они определяют красный цвет крови. Эритроциты имеют форму двояковогнутого диска, средний диаметр которых около 7 – 8,3 мкм, не имеют ядра. Вся цитоплазма сосредоточена по краям,а в центре её мало. В норме допускаяется форма спущенного мяча.
Гемолиз — разрушение эритроцитов крови с выделением в окружающую среду гемоглобина. В норме гемолиз завершает жизненный цикл эритроцитов (120 суток) и происходит в организме человека и животных непрерывно.
Патологический гемолиз происходит под влиянием гемолитических ядов, холода, некоторых лекарственных веществ (у чувствительных к ним людей) и других факторов; характерен для гемолитических анемий. По локализации процесса выделяют несколько типов гемолиза:
1.Внутриклеточный
2.Внутрисосудистый
Скорость оседания эритроцитов (СОЭ) — это скорость разделения несвернувшейся крови в специальном капилляре на два слоя: из осевших эритроцитов (нижний слой) и прозрачной плазмы (верхний слой). СОЭ измеряется в миллиметрах в час.
СОЭ 2-10 мл в час у мужчин, до 15 мл в час у женщин.
Скорость меняется при заболевании или беременности в сторону увеличения.
Лейкоциты— белые кровяные клетки,они крупнее эритроцитов; неоднородная группа различных по внешнему виду и функциям клеток крови человека или животных, выделенная по признакам наличия ядра и отсутствия самостоятельной окраски.
Главная сфера действия лейкоцитов — защита. Они играют главную роль в специфической и не специфической защите организма от внешних и внутренних патогенных агентов, а также в реализации типичных патологических процессов.
Делятся на 2 группы,в зависимости есть ли зернистость в цитоплазме:
- Зернистые — гранулоциты
- Не зернистые — агранулоциты
В зависимости от особенностей восприятия ими стандартных красителей гранулоциты делят на:
Нейтрофилы (фагоциты)— подвижные клетки, их больше всего в цитоплазме, выполняют защитную функцию и способны к фагоцитозу (захват и поглощение). Окрашиваются в сиреневый цвет. Ядро в виде сигментов, соединяющаяся перемычками. Диаметр зрелого нейтрофила — 10-12 мкм. Живут от нескольких часов,до нескольких суток. В крови умирают быстрее.
Эозинофилы. Кол-во увеличивается при аллергических реакциях, глисных инвазиях, их называют «чистильщиками», способны к фагоцитозу. Диаметр до 15 мкм. Окрашиваются кислыми красками в розовый цвет. Ядро в виде сигмета.
Базофилы — это клетки-разведчики. Основная функция базофилов — ускорение подавления аллергенов и препятствие их распространению по всему организму. Очень крупные гранулоциты: они крупнее и нейтрофилов, и эозинофилов. Принимают активное участие в развитии аллергических реакций немедленного типа (реакции анафилактического шока. Относятся к эндокринной системе. Выделяют гистамин и гепарин. Не окрашиваются кислыми красками.
Не зернистые агранулоциты:
Моноцит – крупный зрелый одноядерный лейкоцит группы агранулоцитов диаметром 18—20 мкм. Подвижны и способны к фагоцитозу. Живут от нескольких часов до нескольких суток. Ядро почти во всю клетку,бобовидное.
Лимфоциты-клетки иммунной системы. Величина минимум — 4,5 мкм,максимум — 10 мкм. Ядро круглое,крупное.
2 вида:
Тл ≈ 80% — тимус зависимые.
Тимус — железа,расположенная в пространстве между легкими. Выполняет две функции: эндокринную и иммунную.
Тh хелперы (участвуют в имунных реакциях)
Тk киллеры(убийцы,принимают участие в противоопухолевых процессах)
Тs супрессоры(подавляют иммунные реакции)
Bл≈ 20% — участвуют в выработке антител(белки глобулины)
Лейкоцитарная формула:
Нейтрофилы до 65% зрелые (палочкоядерные дозревают до сигментоядерных)
Базофилы до 1%
Эозинофилы ≈ 1,4% — 5%
Лимфоциты 1,9%-37%
Моноциты 3%-11%
Тромбоциты – то небольшие (2-4 мкм) безъядерные сферические бесцветные тельца крови.
Содержит вещество тромбопластин и принимает участие в свёртывании крови.
Гемограмма— сожержание всех клеток в крови.
Эритроциты. м. 4-5*10^12, ж. 3,9-4,7*10^12 в 1 л
Гемоглобин м.130-160 г в 1 л,ж. 120-140 г в 1 л.
Цветовой показатель — степень насыщеннсоти цитоплазмы эритроцитов гемоглабином. 0,85 — 1,05.
Лейкоциты 4-9*10^12 на 1 л.
Ретикулоциты — не дозревшие лейкоциты. От 2 до 10% от общего числа эритроцитов.
СОЭ м.2-10, ж. 2-15 мл в ч.
Тромбоциты 180-320*10^9 г на л
Гемостаз — комплексная реакция,направленная на остановку кровотечения.
Коагуляция(свертывание) – слипание частиц коллоидной системы и при их столкновениях в процессе теплового (броуновского) движения, перемешивания или направленного перемещения во внешнем силовом поле.
3 стадии свертывания крови:
- Образование активного тромбопрластина. Тромбомбоцит высвобождает тромбопластин под влиянием солей кальция и других факторов превращения в активный тромбопластин.
- Образование тромбина. Активный тромбопласин, соли кальция и другие компоненты плазмы переводят протромбин в тромбин.
- Образование фибрина тромбина,кальций и другие факторы, переводят фибриноген в фибрин.
Фибрин— бесцветный белок,который составляет основу сгустка — тромба, состоит из отдельных нитей, образующих мономер, идёт его полимеризация.
Между нитями фибрина застревают эритроциты.
Кровотечение 5-10 минут, влияет температура.
Кровь хранят в холодильнике при теппературе 4-8°.
Антикоагуляция — антисвёртывающая система,которая препятствует образованию сгустка.
Группы крови
В 1901 году были открыты 4 группы крови. Открыл австрийски(Вена) врач Ландштейнер.
Эти группы отличаются антигенами. Содержание в эритроцитах агглютинигена АВ.
В плазме агглютинигены АВ0 α β
Правила переливания крови:
Переливается только одногруппная кровь.
Донор — тот,кто сдаёт кровь.
Реципиент — тот,кто получает кровь.
Недостаточно знать только группу. Резус-фактор rh — белок,который содержится в эритроцитах.
85% резус +
15% резус —
Биохимия крови
Белки плазмы крови
В плазме крови содержится 7% всех белков организма при концентрации 60 — 80 г/л. Белки плазмы крови выполняют множество функций. Одна из них заключается в поддержании осмотического давления, так как белки связывают воду и удерживают её в кровеносном русле.
• Белки плазмы образуют важнейшую буферную систему крови и поддерживают pH крови в пределах 7,37 — 7,43.
• Альбумин, транстиретин, транскортин, трансферрин и некоторые другие белки выполняют транспортную функцию.
• Белки плазмы определяют вязкость крови и, следовательно, играют важную роль в гемодинамике кровеносной системы.
• Белки плазмы крови являются резервом аминокислот для организма.
• Иммуноглобулины, белки свёртывающей системы крови, α1-антитрипсин и белки системы комплемента осуществляют защитную функцию.
Методом электрофореза на ацетилцеллюлозе или геле агарозы белки плазмы крови можно разделить на альбумины (55 — 65%), α1-глобулины (2 — 4%), α2-глобулины (6 — 12%), β-глобулины (8 — 12%) и н-глобулины (12 — 22%) (рис. 14-19).
Применение других сред для электрофоретического разделения белков позволяет обнаружить большее количество фракций. Например, при электрофорезе в полиакриламидном или крахмальном гелях в плазме крови выделяют 16 — 17 белковых фракций. Метод иммуноэлектрофореза, сочетающий электрофоретический и иммунологический способы анализа, позволяет разделить белки плазмы крови более чем на 30 фракций.
Большинство сывороточных белков синтезируется в печени, однако некоторые образуются и в других тканях. Например, н-глобулины синтезируются В-лимфоцитами (см. раздел 4), пептидные гормоны в основном секретируют клетки эндокринных желёз, а пептидный гормон эритропоэтин — клетки почки.
Для многих белков плазмы, например, альбумина, α1-антитрипсина, гаптоглобина, трансферрина, церулоплазмина, α2-макроглобулина и иммуноглобулинов, характерен полиморфизм.
Почти все белки плазмы, за исключением альбумина, являются гликопротеинами. Олигосахариды присоединяются к белкам, образуя гликозидные связи с гидроксильной группой серина или треонина, или взаимодействуя с карбоксильной группой аспарагина. Концевой остаток олигосахаридов в большинстве случаев представляет собой N-ацетилнейраминовую кислоту, соединённую с галактозой. Фермент эндотелия сосудов нейраминидаза гидролизует связь между ними, и галактоза становится доступной для специфических рецепторов гепатоцитов. Путём эндоцитоза «состарившиеся» белки поступают в клетки печени, где разрушаются. Т1/2 белков плазмы крови составляет от нескольких часов до нескольких недель.
При ряде заболеваний происходит изменение соотношения распределения белковых фракций при электрофорезе по сравнению с нормой.
Такие изменения называют диспротеинемиями, однако их интерпретация часто имеет относительную диагностическую ценность. Например, характерное для нефротического синдрома снижение альбуминов, α1— и y-глобулинов и увеличение α2— и β-глобулинов отмечают и при некоторых других заболеваниях, сопровождающихся потерей белков. При снижении гуморального иммунитета уменьшение фракции y-глобулинов свидетельствует об уменьшении содержания основного компонента иммуноглобулинов — IgG, но не отражает динамику изменений IgA и IgM.
Содержание некоторых белков в плазме крови может резко увеличиваться при острых воспалительных процессах и некоторых других патологических состояниях (травмы, ожоги, инфаркт миокарда). Такие белки называют белками острой фазы, так как они принимают участие в развитии воспалительной реакции организма. Основной индуктор синтеза большинства белков острой фазы в гепатоцитах — полипептид интерлейкин-1, освобождающийся из мононуклеарных фагоцитов. К белкам острой фазы относят С-реактивный белок, называемый так, потому что он взаимодействует с С-полисахаридом пневмококков, α1-антитрипсин, гаптоглобин, кислый гликопротеин, фибриноген. Известно, что С-реактивный белок может стимулировать систему комплемента, и его концентрация в крови, например, при обострении ревматоидного артрита может возрастать в 30 раз по сравнению с нормой. Белок плазмы крови α1-антитрипсин может инактивировать некоторые протеазы, освобождающиеся в острой фазе воспаления.
Содержание некоторых белков в плазме крови и их функции представлены в таблице.
Таблица. Содержание и функции некоторых белков плазмы крови
| Группа | Белки | Концентрация в сыворотке крови, г/л | Функция |
| Альбумины | Транстиретин | 0,25 | Транспорт тироксина и трийодтиронина |
| Альбумин | 40 | Поддержание осмотического давления, транспорт жирных кислот, билирубина, жёлчных кислот, стероидных гормонов, лекарств, неорганических ионов, резерв аминокислот | |
| α1-Глобулины | α1-Антитрипсин | 2,5 | Ингибитор протеиназ |
| ЛПВП | 0,35 | Транспорт холестерола | |
| Протромбин | 0,1 | Фактор II свёртывания крови | |
| Транскортин | 0,03 | Транспорт кортизола, кортикостерона, прогестерона | |
| Кислый α1-гликопротеин | 1 | Транспорт прогестерона | |
| Тироксинсвязывающий глобулин | 0,02 | Транспорт тироксина и трийодтиронина | |
| α2-Г лобулины | Церулоплазмин | 0,35 | Транспорт ионов меди, оксидоредуктаза |
| Антитромбин III | 0,3 | Ингибитор плазменных протеаз | |
| Гаптоглобин | 1 | Связывание гемоглобина | |
| α2-Макроглобулин | 2,6 | Ингибитор плазменных протеиназ, транспорт цинка | |
| Ретинолсвязывающий белок | 0,04 | Транспорт ретинола | |
| Витамин D связывающий белок | 0,4 | Транспорт кальциферола | |
| β-Глобулины | ЛПНП | 3,5 | Транспорт холестерола |
| Трансферрин | 3 | Транспорт ионов железа | |
| Фибриноген | 3 | Фактор I свёртывания крови | |
| Транскобаламин | 25 x 10-9 | Транспорт витамина В12 | |
| Глобулин связывающий белок | 20 x 10-6 | Транспорт тестостерона и эстрадиола | |
| С-реактивный белок | <0,01</p> | Активация комплемента | |
| y-Глобулины | IgG | 12 | Поздние антитела |
| IgA | 3,5 | Антитела, защищающие слизистые оболочки | |
| IgM | 1,3 | Ранние антитела | |
| IgD | 0,03 | Рецепторы В-лимфоцитов | |
| IgE | <0,01</p> | Реагин |
Альбумин. Концентрация альбумина в крови составляет 40-50 г/л. В сутки в печени синтезируется около 12 г альбумина, Т1/2 этого белка — примерно 20 дней. Альбумин состоит из 585 аминокислотных остатков, имеет 17 дисульфидных связей и обладает молекулярной массой 69 кД. Молекула альбумина содержит много дикарбоновых аминокислот, поэтому может удерживать в крови катионы Са2+, Сu2+, Zn2+. Около 40% альбумина содержится в крови и остальные 60% в межклеточной жидкости, однако его концентрация в плазме выше, чем в межклеточной жидкости, поскольку объём последней превышает объём плазмы в 4 раза.
Благодаря относительно небольшой молекулярной массе и высокой концентрации альбумин обеспечивает до 80% осмотического давления плазмы. При гипоальбуминемии осмотическое давление плазмы крови снижается. Это приводит к нарушению равновесия в распределении внеклеточной жидкости между сосудистым руслом и межклеточным пространством. Клинически это проявляется как отёк. Относительное снижение объёма плазмы крови сопровождается снижением почечного кровотока, что вызывает стимуляцию системы ренин-ангиотензин-альдостерон, обеспечивающей восстановление объёма крови. Однако при недостатке альбумина, который должен удерживать Nа+, другие катионы и воду, вода уходит в межклеточное пространство, усиливая отёки.
Гипоальбуминемия может наблюдаться и в результате снижения синтеза альбуминов при заболеваниях печени (цирроз), при повышении проницаемости капилляров, при потерях белка из-за обширных ожогов или катаболических состояний (тяжёлый сепсис, злокачественные новообразования), при нефротическом синдроме, сопровождающемся альбуминурией, и голодании. Нарушения кровообращения, характеризующиеся замедлением кровотока, приводят к увеличению поступления альбумина в межклеточное пространство и появлению отёков. Быстрое увеличение проницаемости капилляров сопровождается резким уменьшением объёма крови, что приводит к падению АД и клинически проявляется как шок.
Альбумин — важнейший транспортный белок. Он транспортирует свободные жирные кислоты, неконъюгированный билирубин, Са2+, Сu2+, триптофан, тироксин и трийодтиронин. Многие лекарства (аспирин, дикумарол, сульфаниламиды) связываются в крови с альбумином. Этот факт необходимо учитывать при лечении заболеваний, сопровождающихся гипоальбуминемией, так как в этих случаях повышается концентрация свободного лекарства в крови. Кроме того, следует помнить, что некоторые лекарства могут конкурировать за центры связывания в молекуле альбумина с билирубином и между собой.
Транстиретин (преальбумин) называют тироксинсвязывающим преальбумином. Это белок острой фазы. Транстиретин относят к фракции альбуминов, он имеет тетрамерную молекулу. Он способен присоединять в одном центре связывания ретинолсвязывающий белок, а в другом — до двух молекул тироксина и трийодтиронина. Соединение с этими лигандами происходит независимо друг от друга. В транспорте последних транстиретин играет существенно меньшую роль по сравнению с тироксинсвязывающим глобулином.
α1-Антитрипсин относят к α1-глобулинам. Он ингибирует ряд протеаз, в том числе фермент эластазу, освобождающийся из нейтрофилов и разрушающий эластин альвеол лёгких. При недостаточности α1-антитрипсина могут возникнуть эмфизема лёгких и гепатит, приводящий к циррозу печени. Существует несколько полиморфных форм α1-антитрипсина, одна из которых является патологической. У людей, гомозиготных по двум дефектным аллелям гена антитрипсина, в печени синтезируется α1-антитрипсин, который образует агрегаты, разрушающие гепатоциты. Это приводит к нарушению секреции такого белка гепатоцитами и к снижению содержания α1-антитрипсина в крови.
Гаптоглобин составляет примерно четверть всех α2-глобулинов. Гаптоглобин при внутрисосудистом гемолизе эритроцитов образует комплекс с гемоглобином, который разрушается в клетках РЭС. Если свободный гемоглобин, имеющий молекулярную массу 65 кД, может фильтроваться через почечные клубочки или агрегировать в них, то комплекс гемоглобин-гаптоглобин имеет слишком большую молекулярную массу (155 кД), чтобы пройти через гломерулы. Следовательно, образование такого комплекса предотвращает потери организмом железа, содержащегося в гемоглобине. Определение содержания гаптоглобина имеет диагностическое значение, например, снижение концентрации гаптоглобина в крови наблюдают при гемолитической анемии. Это объясняют тем, что при Т1/2 гаптоглобина, составляющем 5 дней, и Т1/2 комплекса гемоглобин-гаптоглобин (около 90 мин) увеличение поступления свободного гемоглобина в кровь при гемолизе эритроцитов вызовет резкое снижение содержания свободного гаптоглобина в крови.
Гаптоглобин относят к белкам острой фазы, его содержание в крови повышается при острых воспалительных заболеваниях.
Практическая значимость темы. Кровь является важнейшим и наиболее доступным объектом биохимического исследования. Наиболее изученные компоненты крови — это гемоглобин, альбумин, иммуноглобулины и разнообразные факторы свёртывания. При различных заболеваниях наблюдаются изменения уровня белков в плазме; эти изменения можно обнаружить при электрофорезе. Важным диагностическим признаком при некоторых патологических состояниях служит повышение активности некоторых ферментов плазмы крови. Определение содержания небелковых компонентов плазмы (глюкоза, мочевина, холестерол, билирубин и др.) также используется в диагностике заболеваний.
Общая характеристика
Кровь — жидкая подвижная ткань, циркулирующая в замкнутой системе кровеносных сосудов, транспортирующая различные химические вещества к органам и тканям, и осуществляющая интеграцию метаболических процессов, протекающих в различных клетках.
Кровь состоит из плазмы и форменных элементов (эритроцитов, лейкоцитов и тромбоцитов). Сыворотка крови отличается от плазмы отсутствием фибриногена. 90% плазмы крови составляет вода, 10% — сухой остаток, в состав которого входят белки, небелковые азотистые компоненты (остаточный азот), безазотистые органические компоненты и минеральные вещества.
Белки плазмы крови
Плазма крови содержит сложную многокомпонентную (более 100) смесь белков, различающихся по происхождению и функциям. Большинство белков плазмы синтезируется в печени. Иммуноглобулины и ряд других защитных белков иммунокомпетентными клетками.
Содержание общего белка в сыворотке крови здорового человека составляет 65 — 85 г/л (в плазме крови этот показатель на 2 – 4 г/л выше за счёт фибриногена).
Белковые фракции. При помощи высаливания белков плазмы можно выделить альбуминовую и глобулиновую фракции. В норме соотношение этих фракций составляет 1,5 – 2,5. Использование метода электрофореза на бумаге позволяет выявить 5 белковых фракций (в порядке убывания скорости миграции): альбумины, α1-, α2-, β- и γ-глобулины. При использовании более тонких методов фракционирования в каждой фракции, кроме альбуминовой, можно выделить целый ряд белков.
Альбумины – белки с молекулярной массой около 70000 Да. Благодаря гидрофильности и высокому содержанию в плазме играют важную роль в поддержании коллоидно-осмотического (онкотического) давления крови и регуляции обмена жидкостей между кровью и тканями. Выполняют транспортную функцию: осуществляют перенос свободных жирных кислот, желчных пигментов, стероидных гормонов, ионов Са2+, многих лекарств. Альбумины также служат богатым и быстро реализуемым резервом аминокислот.
α1-Глобулины:
- Кислый α1-гликопротеин (орозомукоид) – содержит до 40% углеводов, изоэлектрическая точка его находится в кислой среде. Функция этого белка до конца не установлена; известно, что на ранних стадиях воспалительного процесса орозомукоид способствует образованию коллагеновых волокон в очаге воспаления.
- α1-Антитрипсин – ингибитор ряда протеаз (трипсина, химотрипсина, калликреина, плазмина). Врождённое снижение содержания α1-антитрипсина в крови может быть фактором предрасположенности к бронхо-лёгочным заболеваниям, так как эластические волокна лёгочной ткани особенно чувствительны к действию протеолитических ферментов.
- Ретинолсвязывающий белок осуществляет транспорт жирорастворимого витамина А.
- Тироксинсвязывающий белок – связывает и транспортирует иодсодержащие гормоны щитовидной железы.
- Транскортин – связывает и транспортирует глюкокортикоидные го рмоны (кортизол, кортикостерон).
α2-Глобулины:
- Гаптоглобины (25% α2-глобулинов) – образуют стабильный комплекс с гемоглобином, появляющимся в плазме в результате внутрисосудистого гемолиза эритроцитов. Комплексы гаптоглобин-гемоглобин поглощаются клетками РЭС, где гем и белковые цепи подвергаются распаду, а железо повторно используется для синтеза гемоглобина. Тем самым предотвращается потеря железа организмом и повреждение почек гемоглобином.
- Церулоплазмин – белок, содержащий ионы меди (одна молекула церулоплазмина содержит 6-8 ионов Cu2+), которые придают ему голубую окраску. Является транспортной формой ионов меди в организме. Обладает оксидазной активностью: окисляет Fe2+ в Fe3+, что обеспечивает связывание железа трансферрином. Способен окислять ароматическиеамины, участвует в обмене адреналина, норадреналина, серотонина.
β-Глобулины:
- Трансферрин – главный белок β-глобулиновой фракции, участвует в связывании и транспорте трёхвалентного железа в различные ткани, особенно в кроветворные. Трансферрин регулирует содержание Fe3+ в крови, предотвращает избыточное накопление и потерю с мочой.
- Гемопексин – связывает гем и предотвращает его потерю почками. Комплекс гем-гемопексин улавливается из крови печенью.
- С-реактивный белок (С-РБ) – белок, способный преципитировать (в присутствии Са2+) С-полисахарид клеточной стенки пневмококка. Биологическая роль его определяется способностью активировать фагоцитоз и ингибировать процесс агрегации тромбоцитов. У здоровых людей концентрация С-РБ в плазме ничтожно мала и стандартными методами не определяется. При остром воспалительном процессе она увеличивается более чем в 20 раз, в этом случае С-РБ обнаруживается в крови. Исследование С-РБ имеет преимущество перед другими маркерами воспалительного процесса: определением СОЭ и подсчётом числа лейкоцитов. Данный показатель более чувствителен, его увеличение происходит раньше и после выздоровления быстрее возвращается к норме.
γ-Глобулины:
- Иммуноглобулины (IgA, IgG, IgM, IgD, IgE) представляют собой антитела, вырабатываемые организмом в ответ на введение чужеродных веществ с антигенной активностью.
Количественные и качественные изменения белкового состава плазмы крови. При различных патологических состояниях белковый состав плазмы крови может изменяться. Основными видами изменений являются:
- Гиперпротеинемия — увеличение содержания общего белка плазмы. Причины: потеря большого количества воды (рвота, диарея, обширные ожоги), инфекционные заболевания (за счёт увеличения количества γ-глобулинов).
- Гипопротеинемия — уменьшение содержания общего белка в плазме. Наблюдается при заболеваниях печени (вследствие нарушения синтеза белков), при заболеваниях почек (вследствие потери белков с мочой), при голодании (вследствие недостатка аминокислот для синтеза белков).
- Диспротеинемия — изменение процентного соотношения белковых фракций при нормальном содержании общего белка в плазме крови, например, снижение содержания альбуминов и увеличение содержания одной или нескольких глобулиновых фракций при различных воспалительных заболеваниях.
- Парапротеинемия — появление в плазме крови патологических иммуноглобулинов — парапротеинов, отличающихся от нормальных белков по физико-химическим свойствам и биологической активности. К таким белкам относятся, например, криоглобулины, образующие друг с другом преципитаты при температуре ниже 37° С. Парапротеины обнаруживаются в крови при макроглобулинемии Вальденстрема, при миеломной болезни (в последнем случае они могут преодолевать почечный барьер и обнаруживаться в моче как белки Бенс-Джонса). Парапротеинемия, как правило, сопровождается гиперпротеинемией.
Липопротеиновые фракции плазмы крови. Липопротеины — сложные соединения, осуществляющие транспорт липидов в крови. В состав их входят: гидрофобное ядро, содержащее триацилглицеролы и эфиры холестерола, и амфифильная оболочка, образованная фосфолипидами, свободным холестеролом и белками-апопротеинами. В плазме крови человека содержатся следующие фракции липопротеинов:
- Липопротеины высокой плотности или α-липопротеины, так как при электрофорезе на бумаге они движутся вместе с α-глобулинами. Содержат много белков и фосфолипидов, транспортируют холестерол из периферических тканей в печень.
- Липопротеины низкой плотности или β-липопротеины, так как при электрофорезе на бумаге они движутся вместе с β-глобулинами. Богаты холестеролом; транспортируют его из печени в периферические ткани.
- Липопротеины очень низкой плотности или пре-β-липопротеины (на электрофореграмме расположены между α- и β-глобулинами). Служат транспортной формой эндогенных триацилглицеролов, являются предшественниками липопротеинов низкой плотности.
- Хиломикроны — электрофоретически неподвижны; в крови, взятой натощак, отсутствуют. Являются транспортной формой экзогенных (пищевых) триацилглицеролов.
Белки острой фазы воспаления. Это белки, содержание которых увеличивается в плазме крови при остром воспалительном процессе. К ним относятся, например, следующие белки:
- гаптоглобин;
- церулоплазмин;
- С-реактивный белок;
- α1-антитрипсин;
- фибриноген.
Скорость синтеза этих белков увеличивается прежде всего за счёт снижения образования альбуминов, трансферрина и альбуминов (небольшая фракция белков плазмы, обладающая наибольшей подвижностью при диск-электрофорезе, и которой соответствует полоса на электрофореграмме перед альбуминами), концентрация которых при остром воспалении снижается.
Биологическая роль белков острой фазы: а) все эти белки являются ингибиторами ферментов, освобождаемых при разрушении клеток, и предупреждают вторичное повреждение тканей; б) эти белки обладают иммунодепрессорным действием.
Защитные белки плазмы крови. К белкам, выполняющим защитную функцию, относятся иммуноглобулины и интерфероны.
Иммуноглобулины (антитела) — группа белков, вырабатываемых в ответ на попадание в организм чужеродных структур (антигенов). Они синтезируются в лимфоузлах и селезёнке лимфоцитами В. Выделяют 5 классов иммуноглобулинов — IgA, IgG, IgM, IgD, IgE.
Молекулы иммуноглобулинов имеют единый план строения. Структурную единицу иммуноглобулина (мономер) образуют четыре полипептидные цепи, соединённые между собой дисульфидными связями: две тяжёлые (цепи Н) и две лёгкие (цепи L). IgG, IgD и IgЕ по своей структуре, как правило, являются мономерами, молекулы IgM построены из пяти мономеров, IgA состоят из двух и более структурных единиц, или являются мономерами.
Белковые цепи, входящие в состав иммуноглобулинов, можно условно разделить на специфические домены, или области, имеющие определённые структурные и функциональные особенности.
N-концевые участки как L-, так и Н-цепей называются вариабельной областью (V), так как их структура характеризуется существенными различиями у разных классов антител. Внутри вариабельного домена имеются 3 гипервариабельных участка, отличающихся наибольшим разнообразием аминокислотной последовательности. Именно вариабельная область антител ответственна за связывание антигенов по принципу комплементарности; первичная структура белковых цепей в этой области определяет специфичность антител.
С-концевые домены Н- и L-цепей обладают относительно постоянной первичной структурой в пределах каждого класса антител и называются константной областью (С). Константная область определяет свойства различных классов иммуноглобулинов, их распределение в организме, может принимать участие в запуске механизмов, вызывающих уничтожение антигенов.
Интерфероны — семейство белков, синтезируемых клетками организма в ответ на вирусную инфекцию и обладающих противовирусным эффектом. Различают несколько типов интерферонов, обладающих специфическим спектром действия: лейкоцитарный (α-интерферон), фибробластный (β-интерферон) и& иммунный (γ-интерферон). Интерфероны синтезируются и секретируются одними клетками и проявляют свой эффект, воздействуя на другие клетки, в этом отношении они подобны гормонам.
Связываясь с клеточными рецепторами, интерфероны индуцируют синтез двух ферментов — 2′,5′-олигоаденилатсинтетазы и протеинкиназы, вероятно, за счет инициации транскрипции соответствующих генов. Оба образующихся фермента проявляют свою активность в присутствии двухцепочечных РНК, а именно такие РНК являются продуктами репликации многих вирусов или содержатся в их вирионах. Первый фермент синтезирует 2′,5′-олигоаденилаты (из АТФ), которые активируют клеточную рибонуклеазу I; второй фермент фосфорилирует фактор инициации трансляции IF2. Конечным результатом этих процессов является ингибирование биосинтеза белка и размножения вируса в инфицированной клетке.
Ферменты плазмы крови. Все ферменты, содержащиеся в плазме крови, можно разделить на три группы:
- секреторные ферменты — синтезируются в печени, выделяются в кровь, где выполняют свою функцию (например, факторы свёртывания крови);
- экскреторные ферменты — синтезируются в печени, в норме выделяются с желчью (например, щелочная фосфатаза), их содержание и активность в плазме крови возрастает при нарушении оттока желчи;
- индикаторные ферменты — синтезируются в различных тканях и попадают в кровь при разрушении клеток этих тканей. В разных клетках преобладают различные ферменты, поэтому при повреждении того или иного органа в крови появляются характерные для него ферменты. Это может быть использовано в диагностике заболеваний.
Например, при повреждении клеток печени (гепатит) в крови возрастает активность аланинаминотраноферазы (АЛТ), аспартатаминотрансферазы (ACT), изофермента лактатдегидрогеназы ЛДГ5, глутаматдегидрогеназы, орнитинкарбамоилтрансферазы.
При повреждении клеток миокарда (инфаркт) в крови возрастает активность аспартатаминотрансферазы (ACT), иэофермента лактатдегидрогеназы ЛДГ1, изофермента креатинкиназы MB.
При повреждении клеток поджелудочной железы (панкреатит) в крови возрастает активность трипсина, α-амилазы, липазы.
Частые вопросы
Каков состав крови человека?
Кровь человека состоит из плазмы и форменных элементов. Плазма составляет около 55% общего объема крови и состоит из воды, белков, электролитов, гормонов и других веществ. Форменные элементы включают эритроциты, лейкоциты и тромбоциты.
Какие физико-химические свойства имеет кровь человека?
Кровь имеет такие физико-химические свойства, как кислотно-щелочной баланс (pH), вязкость, плотность, осмотическое давление и коагулируемость. Кислотно-щелочной баланс крови поддерживается на уровне 7,35-7,45. Вязкость крови зависит от ее состава и может быть повышена при различных заболеваниях. Плотность крови составляет примерно 1,05 г/мл. Осмотическое давление крови поддерживается за счет наличия различных веществ, таких как белки и электролиты. Кровь также имеет способность свертываться для образования сгустков при повреждении сосудов.
Полезные советы
СОВЕТ №1
Регулярно проверяйте свой уровень гемоглобина. Гемоглобин – это важный показатель состояния крови, который отражает содержание кислорода в организме. Если уровень гемоглобина низкий, это может указывать на анемию или другие проблемы со здоровьем. При необходимости проконсультируйтесь с врачом и примите меры для улучшения состояния крови.
СОВЕТ №2
Увеличьте потребление железа и витамина С. Железо является основным компонентом гемоглобина, поэтому его достаточное потребление в пище важно для поддержания здорового уровня крови. Витамин С помогает организму лучше усваивать железо. Включите в свой рацион пищу, богатую железом, такую как мясо, рыба, орехи и зеленые овощи, а также продукты, содержащие витамин С, например, цитрусовые фрукты, киви и перец.
СОВЕТ №3
Поддерживайте оптимальный уровень гидратации. Вода играет важную роль в составе крови и помогает поддерживать ее физико-химические свойства. Регулярно пейте достаточное количество воды, чтобы предотвратить обезвоживание и поддерживать здоровое состояние крови.